 Forse il più grande sogno dell’uomo è da sempre quello di sconfiggere la morte e prolungare la vita oltre i naturali limiti biologici. Anche se un’esistenza troppo protratta nel tempo può non essere esattamente, per me come per altri, l’immagine del vivere felice, è pur vero che l’uomo ha da sempre inseguito il miraggio di una vita senza fine. Forse il più grande sogno dell’uomo è da sempre quello di sconfiggere la morte e prolungare la vita oltre i naturali limiti biologici. Anche se un’esistenza troppo protratta nel tempo può non essere esattamente, per me come per altri, l’immagine del vivere felice, è pur vero che l’uomo ha da sempre inseguito il miraggio di una vita senza fine.
A cominciare dal primo re di Ur Gilgamesh e dal mitico Thot, i cui insegnamenti su come garantirsi la vita eterna sono andati perduti; per proseguire con Ermete Trismegisto e la sua Tavola Smeraldina o ancora con gli alchimisti del medioevo, ultimo di loro Fulcanelli, giù giù fino alla geniale originalità di Oscar Wilde che ha saputo interpretare, con tratti innovativi, un tema da sempre vivo nella letteratura, prefigurando il mito dell’immortalità nei delicati tratti di Dorian Grey.
Anche la scienza, con le sue ricerche in campo biologico e medico, ma anche ingegneristico e nanotecnologico, si dimostra sensibile a questo tema e i suoi progressi sembrano ampliare giorno dopo giorno i confini della vita fino a spingersi ai limiti dell’oltre-umano.
E a questo proposito non più di qualche anno, nell’ottobre 2009, il Nobel per la Medicina fu assegnato ad Elizabeth Blackburn dell’University of California, a Carol Greider della Johns Hopkins University, School of Medicine di Baltimora e a Jack Szostak della Harvard Medical School di Boston per una ricerca che apre la strada allo studio della longevità!
Vediamo di capire di che cosa si tratta.
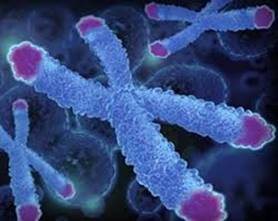
Nel nucleo delle cellule è contenuto il nostro patrimonio genetico, il DNA, che, quando la cellula si sta per dividere, si organizza in strutture tridimensionali: i cromosomi. Nella struttura dei cromosomi, le estremità vengono chiamate telomeri e già nel 1938 Hermann Muller e poi Barbara McClintock nel 1941 avevano dimostrato che essi svolgono un’importante funzione protettiva nei confronti dei cromosomi stessi, garantendo l’integrità dell’intera struttura e prevenendo il rischio della fusione dei diversi cromosomi tra loro e quindi le relative conseguenze disastrose.
Ma i telomeri, oltre a svolgere questa funzione protettiva, rappresentano anche una sorta di orologio biologico: in seguito ad ogni evento di riproduzione cellulare la loro lunghezza infatti si riduce progressivamente fino al punto di non consentire più l’esplicazione della loro funzione protettiva nei confronti dei cromosomi.
E a questo punto le cellule, non più capaci di riprodursi correttamente, invecchiano e muoiono.
Infatti quando una cellula è sul punto di dividersi per dare origine a due cellule-figlie (il suo modo di essere immortale), le sue molecole di DNA devono essere interamente duplicate affinché possa trasmettere ad ognuna delle "nuove" cellule il suo stesso materiale genetico completo. Ma durante il processo di duplicazione, nella maggior parte delle cellule, i telomeri non sono copiati per intero: in questo caso le cellule figlie avranno cromosomi dai telomeri “più corti”, saranno in qualche modo "difettose" e avranno un potenziale di vita più breve. Quindi, ogni volta che una cellula si duplica perde una sequenza dei telomeri e infine, quando ha esaurito la sua dotazione di sequenze, muore.
Circa quarant’anni fa, nel 1961 il biologo statunitense Leonard Hayflick aveva evidenziato, in uno studio pionieristico, che un certo tipo di cellule umane - i fibroblasti -, fatte crescere in coltura, perdevano la capacità di proliferare dopo circa 50 divisioni e aveva anche dimostrato come, in generale, le cellule umane normali dei diversi tessuti ed organi fossero in grado di dividersi un numero finito di volte e che, al termine della loro dotazione di replicazioni, andassero incontro ad un arresto della crescita e diventassero senescenti.
Quindi le cellule normali in qualche modo contano il loro numero di possibili divisioni proprio come noi contiamo gli anni della nostra vita e quindi il nostro invecchiamento.
Questa scoperta è nota in genetica come “limite di Hayflick” e assume che ogni tipo di cellula abbia un limite del suo potenziale replicativo fissato intrinsecamente.
In altre parole, ogni cellula può replicarsi un numero limitato di volte, secondo una specie di “conto alla rovescia” fino alla morte, e tale numero (numero di Hayflick) dipende dal tipo di cellula e dalla specie cui appartiene.
Egli allora non seppe definire quale struttura della cellula fosse responsabile del “conto alla rovescia”, ma oggi sembra che le teorie genetiche dei telomeri possano fornire una spiegazione chiara a tale fenomeno.
Furono proprio Elizabeth Blackburn e Jack Szostak che nel 1978, lavorando con il protozoo ciliato Tetrahymena thermophila, dimostrarono che i telomeri dei cromosomi di questo organismo erano caratterizzati dal possedere molte ripetizioni di una breve sequenza di nucleotidi (*) (TTGGGG), sequenza che è stata poi dimostrata essere presente, con alcune varianti (GGGTTA), anche in altre specie come funghi, vegetali e mammiferi, uomo compreso. E qualche anno più tardi, il giorno di Natale del 1984, Carol Greider, insieme alla Blackburn della quale era allieva, scoprì che vi era un enzima preposto a sintetizzare, nella fase di duplicazione del DNA, tali sequenze ripetute dei telomeri.
L’enzima fu battezzato “telomerasi”, fu purificato e venne dimostrato che è costituito dall’acido nucleico RNA e da proteine, svolgenti entrambi una precisa funzione nella costruzione delle sequenze dei telomeri.
Senza questo enzima, ad ogni duplicazione, si perdono 50-100 nucleotidi da ciascun telomero di ogni cromosoma e ciò vuol dire che, dopo un certo numero di generazioni cellulari, le cellule discendenti erediteranno cromosomi “incompleti” e non si divideranno più, entrando in quella fase detta senescenza replicativa cellulare.
Se l’enzima telomerasi è presente, ogni volta che la cellula si duplica esso sintetizza sempre nuove sequenze telomeriche, aggiungendo copie delle brevi sequenze ripetute di cui si è detto, evitando così che la cellula entri in senescenza.
Va detto che la telomerasi rimane attiva in quelle cellule che si devono riprodurre frequentemente, come le staminali embrionali e le cellule germinali (uovo e spermatozoo) che sono preposte a generare la nuova vita.
Ma nelle cellule somatiche, che sono le principali costituenti di un organismo vivente, l'attività telomerasica tende nel tempo a scomparire o, come proposto, ad essere “disattivata” con il conseguente accorciamento delle estremità dei cromosomi che risulta correlato all'invecchiamento.
Il fatto che ogni telomero si accorci nelle successive divisioni cellulari e che invece, in presenza della telomerasi, le cellule diventino quasi immortali ha suggerito che la lunghezza del telomero agisca come orologio mitotico responsabile della limitata durata della vita della nostra e delle altre specie viventi.
Questa teoria dell’orologio mitotico, non appena formulata, portò ad un’ondata di euforia nell’ambiente della scienza in quanto si ipotizzò che, se i telomeri erano i responsabili dell’invecchiamento, bloccando il loro accorciamento si sarebbe potuta raggiungere in qualche modo l’immortalità cellulare di organi e tessuti.
A riguardo furono fatti numerosi studi nel tentativo di comprendere meglio la correlazione tra lunghezza dei telomeri e spettanza di vita, con i risultati più vari. Nel 1996, per esempio, la clonazione della pecora Dolly mise in allarme gli studiosi che erano alla ricerca dell'elisir dell'eterna giovinezza: la pecora clonata invecchiava infatti molto rapidamente manifestando in tempi molto brevi caratteristiche simili a quelle della madre dalla quale era sta clonata.
Quattro anni più tardi, tali risultati furono capovolti nel centro di ricerca dell'Advanced Cell Technology di Worcester (Massachusetts) con un esperimento che portò alla clonazione di sei vitelli nei quali le cellule risultavano più giovani di quelle dalle quali erano stati clonati. Analizzando i loro telomeri si era visto che erano più lunghi rispetto a quelli dei soggetti di partenza.
Ancora nel 2003 altri studi avevano sorprendentemente dimostrato che, nell'uccello delle tempeste codaforcuta (Oceanodroma leucorhoa), i telomeri si allungano progressivamente con l'invecchiamento dell'organismo. Ma subito dopo, nel 2004, in un altro studio condotto su due popolazioni di vermi, Caenorhabditis elegans, aventi come unica differenza la lunghezza dei telomeri, fu dimostrato che quelli con i telomeri più lunghi avevano un'aspettativa di vita superiore in media del 20%.
Alcune ricerche dimostrarono in cellule in coltura che in alcuni casi è possibile avviare o fermare l'orologio cellulare attivando o bloccando proprio la telomerasi: con l’inserimento infatti dell’enzima attivo in cellule nelle quali normalmente era “spento” si ottenevano telomeri più lunghi e rallentamento della senescenza cellulare.
In condizioni normali le cellule della maggior parte dei tessuti umani gradualmente rallentano la loro crescita, in proporzione proprio all’accorciamento dei telomeri. Le cellule normali di individui anziani perdono la capacità di dividersi molto più velocemente rispetto a quelle di un giovane ed il numero delle cellule che sono senescenti aumenta con l’età. Questo accade perché nella maggior parte delle cellule di un organismo, come si è detto, il gene che produce la telomerasi viene “disattivato” già negli stadi precoci dello sviluppo; come conseguenza i telomeri, accorciandosi ad ogni divisione cellulare, agiranno come uno strumento di misura che conti le divisioni cellulari e regoli così la durata della vita della cellula.
Mentre l’accorciamento dei telomeri regola quindi la storia replicativa della cellula, si può pensare che il loro allungamento fornisca longevità.
Sicuramente la tematica è davvero intrigante, anche se non priva ancor oggi di lati oscuri. Dobbiamo ragionare pensando ad un organismo pluricellulare come un ecosistema nel quale i singoli individui sono le cellule, organizzate in gruppi di collaborazione: i tessuti e gli organi.
In un organismo sano tutte le cellule somatiche sono destinate alla fine a morire, non lasciando progenie ma dedicando la loro esistenza alla produzione e alla conservazione delle cellule germinali, le uniche ad avere, attraverso la fecondazione, una probabilità di continuare a vivere in un nuovo individuo.
Mentre infatti le cellule che vivono libere come i batteri competono tra loro per sopravvivere, le cellule di un organismo pluricellulare sono impegnate a collaborare. E così ciascuna di esse si comporta in modo “socialmente responsabile” occupando il proprio posto, rimanendo quiescente, dividendosi o differenziandosi ed anche morendo in base a ciò che è necessario per l’organismo. Ogni corpo è infatti un clone, derivando ogni sua parte da un’unica cellula, ed il patrimonio genetico delle cellule somatiche è perciò lo stesso di quello delle cellule germinali. Ed è solo con il loro sacrificio, che le cellule somatiche potranno garantire il bene delle germinali e permettere la propagazione dei loro stessi geni.
Alterazioni molecolari che disturbino questa armonia hanno conseguenze gravi per l’intero organismo.
Ma perché le cellule somatiche progressivamente accorciano i loro telomeri e infine entrano in senescenza?
La spiegazione di ciò è che in tal modo probabilmente si evita il rischio di una pericolosa deriva proliferativa della cellula stessa, cioè una proliferazione incontrollata di cellule ribelli nei tessuti adulti.
Se l'attività della telomerasi rimane elevata, i telomeri mantengono la loro lunghezza e la senescenza cellulare viene ritardata; questo accade soprattutto nelle cellule tumorali dove l’attivazione dell’enzima telomerasi fa sì che queste cellule siano virtualmente immortali.
Si pensa che il potenziale replicativo e moltiplicativo di ogni cellula sia regolato in modo da consentire crescita, sviluppo, riparazione di eventuali danni e mantenimento di caratteristiche normali della cellula stessa, ma non sia così elevato tanto da dar luogo ad un numero di divisioni eccessivo che comporterebbe il rischio di accumulare alterazioni e mutazioni capaci di far diventare maligna la cellula. Una cellula, arrivata naturalmente alla senescenza, non si divide più, ma se in una qualche fase della sua vita ha subito una mutazione che per esempio le permetta di continuare a dividersi, essa avrà acquistato un enorme vantaggio competitivo nei confronti di tutte le altre dell’organismo.
Vale a dire che, da questo punto di vista, l’accorciamento dei telomeri potrebbe essere considerato un meccanismo che limita il potenziale mitotico di ogni tipo cellulare e quindi la senescenza cellulare essere considerata un potente meccanismo soppressivo del tumore.
Le osservazioni sui telomeri e sulla telomerasi hanno aperto una strada estremamente significativa nella conoscenza dei meccanismi che regolano la trasformazione delle cellule nel tempo ed hanno posto le basi per ulteriori ricerche sull'invecchiamento cellulare, sul cancro e conseguentemente sulla possibilità di mettere a punto nuovi farmaci antitumorali.
Questi studi sono particolarmente interessanti perché riguardano un campo della scienza molto delicato come quello che è legato al tempo con il quale misurare la vita sia delle cellule ma alla fine anche dell’uomo.
Ancora una volta non si può non rimanere affascinati dal mondo della biologia nel quale le stesse leggi che regolano il mondo del piccolo sono quelle che disciplinano il macrocosmo.
Nella Tavola Smeraldina, che la tradizione vuole sia stata incisa con punta di diamante su una lastra verde di smeraldo da Ermete Trismegisto e che Sara, moglie di Abramo, la rinvenisse nella sua tomba, si affermava che “L’Esterno è come l’Interno; il Piccolo è come il Grande; ciò che è in Basso è come ciò che è in Alto”.
(*) vedi articolo di novembre 2009 |

